Mit den neuen Antikörpern Donanemab und Lecanemab stehen erstmals von der EMA zugelassene Medikamente zur Verfügung, welche eine Modifikation und somit eine Änderung des natürlichen Verlaufs der Alzheimer Erkrankung ermöglichen. Kurzgefasst, das Fortschreiten der Erkrankung kann signifikant verzögert.
Zwischenzeitlich wurden beide neuen Antikörper (Lequembi ®und Kisunla®) für die Therapie der frühen Alzheimer Erkrankung zugelassen. In umfangreichen Studien konnte für beide Antikörper eine circa 30-prozentige Reduktion des Fortschreitens der kognitiven Beeinträchtigungen nachgewiesen werden, inklusive eines Nachweises sekundärer Studienparameter, wie zum Beispiel die Reduktion von Alzheimer-typischen Eiweißablagerungen(Amyloid) durch PET oder Liquor. Dies war bislang mit den verfügbaren Medikamenten nicht möglich, somit stellen beide Antikörper einen Quantensprung in der Behandlung dieser desaströsen Erkrankung dar.
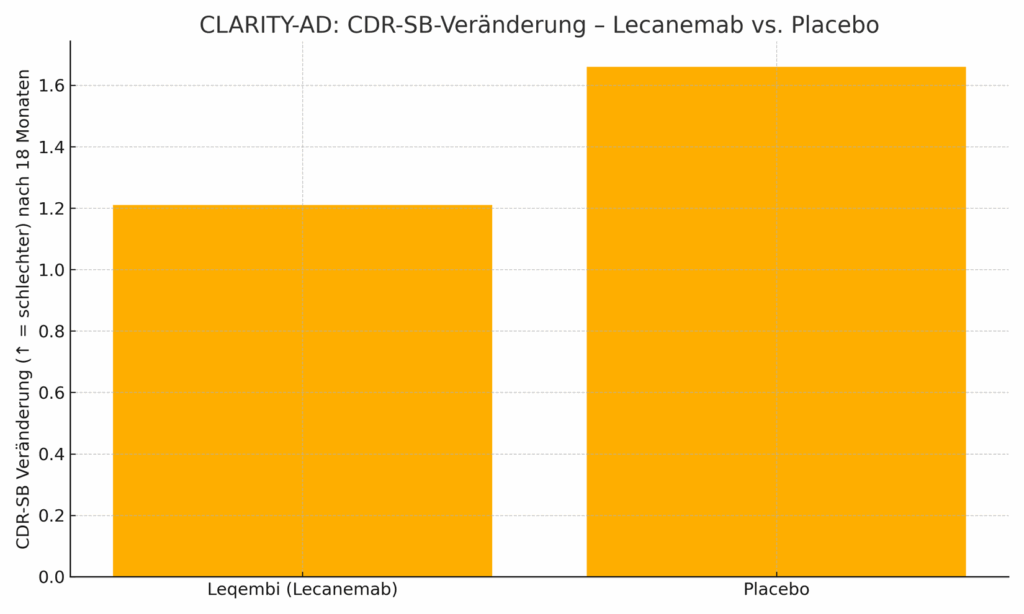
Lecanemab (Lequembi®) zielt auf löslich- protofibrilläres Amyloid-beta ab und wird als Infusion alle 14 Tage verabreicht. Geeignet sind Patienten mit einer leichten kognitiven Beeinträchtigung oder milden Demenz. Ausgeschlossen sind jedoch Patienten mit einer bestimmten genetischen Charakteristik (Apo E e4 homozygote Patienten) oder solche Patienten, bei denen ein besonders hohes Blutungsrisiko besteht. In der wesentlichen CLARITY AD – Studie, welche 2023 im New England Journal of Medicine publiziert wurde, konnte der primäre Endpunkt in der Verumgruppe eine Reduktion und somit eine Verlangsamung des kognitiven Parameters CDR-SB um circa 30 % nachweisen sowie konsistente positive Veränderungen auch im Bereich sekundär Endpunkte.
Donanemab (Kisunla®) zielt auf fibrilläre Plaques ab und wird im Gegensatz zu Lequembi einmal monatlich intravenös verabreicht. Die relevante Studie TRAIL BLAZER ALZ 2 wurde im Jahr 2023 veröffentlicht (JAMA), zeigte eine Abnahme des primären Studienendpunktes, des CDR-SB nach 76 Wochen um circa 35 %. Die stärksten Effekte wurden zudem bei Patienten mit niedriger oder geringer zusätzlicher Belastung mit Tau Protein in der PET gezeigt.
Beide Medikamente haben als Nebenwirkungen typische MRT-Veränderungen (ARIA E, ARIA H), die klinisch als Hirnschwellung oder Blutungen auftreten, welche in Einzelfällen tödlich endeten. Die europäische Arzneimittelbehörde sieht dennoch ein deutliches Überwiegen des Nutzens gegenüber der möglichen Risiken dieser Medikamente und verlangt zugleich eine strenge Patienten-Auswahl mit Berücksichtigung relevanter Risikofaktoren (Genetische Typisierung, MRT vor Beginn und in den ersten sechs Monaten engmaschig nach Therapiebeginn etc.) sowie die strenge Einhaltung weiterer Ausschlusskriterien.
Die Medikamente werden künftig in Österreich an spezialisierten Zentren in den jeweiligen Bundesländern nach eigenen Behandlungspfaden an geeignete Patienten verabreicht werden; man geht davon aus dass, nur ein Bruchteil der neu erkrankten Patienten auch tatsächlich geeignete Kandidaten für diese Therapie sein werden, wobei künftig auch andere, neue Antikörper und auch andere neue Verabreichungsmethoden bereits getestet werden, um Nebenwirkungen zu minimieren und die Verabreichungsmethoden zu erleichtern (z.B. Infusionen über die Haut). Auch hinsichtlich der potenziell gefährlichen Nebenwirkungen ist man dabei Lösungen zu suchen, welche diese Risiken minimieren (z.B. niedrigere Anfangsdosis etc.).
Künftig Alzheimerdiagnostik aus dem Blut?
Da Antikörper in sehr frühen Erkrankungsstadien eingesetzt werden sollten ist auch eine frühzeitige Diagnostik unumgänglich. Hier könnten die neuen Bluttest zu Alzheimer Diagnostik (pTau181, pTAU 271, A 42/40 Ratio) im klinischen Alltag eine deutliche Erleichterung bringen. Sie könnten ein wesentlicher Puzzle Stein in der frühen Diagnose zum Ein- oder Ausschluss von Patienten für die Antikörper Therapie darstellen. Neben dem bereits von „Labors a.t“ Österreich zur Verfügung gestellten Bluttest, der die Amyloid ß 42/40 Ratio aus dem Plasma misst, wird demnächst auch der von der Firma Roche (Elecsys®) verfügbare pTAU181-Test die Diagnostik erweitern. Gemeinsam mit dem Nachweis der Amyloid ß42/40 Ration könnte der pTAU 181 Test aus dem Blut neben einer „rule out“ auch „rule in“ Diagnostik gelingen. Derzeit sind diese Tests aber keine Standardleistungen der Krankenkassen und privat zu bezahlen.
Bei all den Fortschritten bleibt jedoch zu bedenken, dass immer alle Befunde in Zusammenschau mit der Klinik von einem erfahrenen Spezialisten im Bereich der Demenzerkrankungen interpretiert werden müssen, da es eine Vielzahl an Einfluss und Störfaktoren gibt und diese die Aussagekraft der Tests beeinflussen können. Es bleibt spannend abzuwarten, inwieweit weiter Entwicklungen die frühe Diagnostik aber auch die Therapie der Alzheimer Erkrankung weiter in Richtung einer gut behandelbar Erkrankung mit einer effektiven Linderung der klinischen Symptome verändern werden.
Wirksamkeitsgrafik aus Studiendaten:
Abb. 1: CLARITY‑AD – Veränderung der CDR‑SB (je kleiner, desto besser).
Literatur beim Autor